
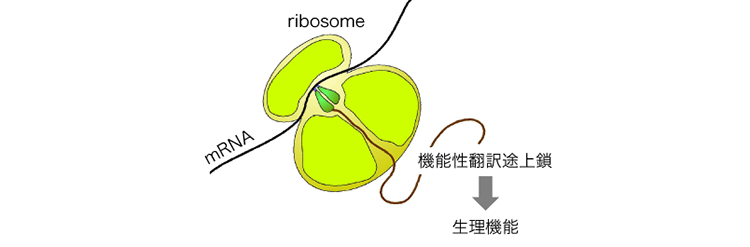
機能性翻訳途上鎖(機能性新生鎖)は、原核生物から真核生物まで広く見出されており、翻訳途上のタンパク質が生理機能を発揮するという点で典型的なタンパク質と大きく異なる(図)。これらは、「制御された翻訳アレスト」という共通の機構で多様な生理機能を発揮する。本領域が指向する「従来のタンパク質科学の枠組みを超えた先にある未開のタンパク質の世界を明らかにする」という点で、このようなユニークな機能発現をする機能性翻訳途上鎖は興味深い研究対象であるが、この翻訳アレストの分子機構や機能発現様式の共通性と多様性については、未だ知見が限定的であり、機能性新生鎖に共通の作動原理があるのか否かについては明らかにされていない。
以前我々は、枯草菌に由来する機能性翻訳途上鎖MifMを発見した(Chiba et al., EMBO J. 2009)。さらに、最近になり、他の真正細菌の翻訳アレスト因子を新たに3つ同定した(Sakiyama et al., Nucleic Acids Res. 2021)。本研究では、特に後者の3種類の翻訳アレスト因子の分子機構と生理機能を、遺伝学、生化学、の手法を用いてそれぞれ解析することを目指す。また、真核生物の翻訳アレスト因子の解析を担当する分担者の内藤らと協力し、翻訳アレストの分子機構に生物種を超えた共通性が存在するのか否か、また、生物種の違いにより翻訳アレストやその機能発現にどのような多様性が生じるのかを解明することを目指す。さらに、これらの解析を発展させ、翻訳アレストの引っ張り力に対する感受性を利用した「引っ張り力センサー」の開発を目指す。
- Sakiyama K, Shimokawa-Chiba N, Fujiwara K and Chiba S. Search for translation arrest peptides encoded upstream of genes for components of protein localization pathways. Nucleic Acids Res. 49, 1550-1566 (2021) doi: 10.1093/nar/gkab024.
- Fujiwara K, Katagi Y, Ito K and Chiba S. Proteome-wide Capture of Co-translational Protein Dynamics in Bacillus subtilis Using TnDR, a Transposable Protein-Dynamics Reporter. Cell Rep. 33, 108250 (2020) doi: 10.1016/j.celrep.2020.108250.
- *Shimokawa-Chiba N, *Müller C, Fujiwara K, Beckert B, Ito K, #Wilson D. N, #Chiba S. Release factor-dependent ribosome rescue by BrfA in the Gram-positive bacterium Bacillus subtilis. Nat. Commun. 10, 5397 (2019) doi:10.1038/s41467-019-13408-7 (* equally contributed; # corresponding authors)
- Fujiwara K, Ito K and Chiba S. MifM-instructed translation arrest involves nascent chain interactions with the exterior as well as the interior of the ribosome. Sci Rep. 8, 10311 (2018) doi: 10.1038/s41598-018-28628-y.
- Sohmen D, Chiba S, Shimokawa-Chiba N, Innis A, Berninghausen O, Beckmann R, Ito K and Wilson D. Structure of the Bacillus subtilis 70S ribosome reveals the basis for species-specific stalling. Nat. Commun. 6, 6941 (2015) doi: 10.1038/ncomms7941.
- Shimokawa-Chiba N, Kumazaki K, Tsukazaki T, Nureki O, Ito K and Chiba S. Hydrophilic microenvironment required for the channel-independent insertase function of YidC protein. Proc. Natl. Acad. Sci. USA. 112, 5063-5068 (2015) doi: 10.1073/pnas.1423817112.
- *Kumazaki K, *Chiba S, Takemoto M, Furukawa A, Nishiyama K.I, Sugano Y, Mori T, Dohmae N, Hirata K, Nakada-Nakura Y, Maturana A.D, Tanaka Y, Mori H, Sugita Y, Arisaka F, Ito K, Ishitani R, Tsukazaki T and Nureki O. Structural basis of Sec-independent membrane protein insertion by YidC. Nature, 509, 516-520 (2014) doi: 10.1038/nature13167. (*These authors contributed equally to this work)
- Ito K and Chiba S. Arrest peptides: cis-acting modulators of translation. Annu. Rev. Biochem. 82, 171-202 (review) (2013) doi: 10.1146/annurev-biochem-080211-105026.
- Chiba S and Ito K. Multisite ribosomal stalling: A unique mode of regulatory nascent chain action revealed for MifM. Mol. Cell 47, 863-872 (2012) doi: 10.1016/j.molcel.2012.06.034.
- Chiba S, Kanamori T, Ueda T, Akiyama Y, Pogliano K and Ito K. Recruitment of a species-specific translational arrest module to monitor different cellular processes. Proc. Natl. Acad. Sci. USA. 108, 6073-6078 (2011) doi: 10.1073/pnas.1018343108.
- Chiba S, Lamsa A and Pogliano K. A ribosome-nascent chain sensor of membrane protein biogenesis in Bacillus subtilis. EMBO J. 18, 3461-3475 (2009) doi: 10.1038/emboj.2009.280.

