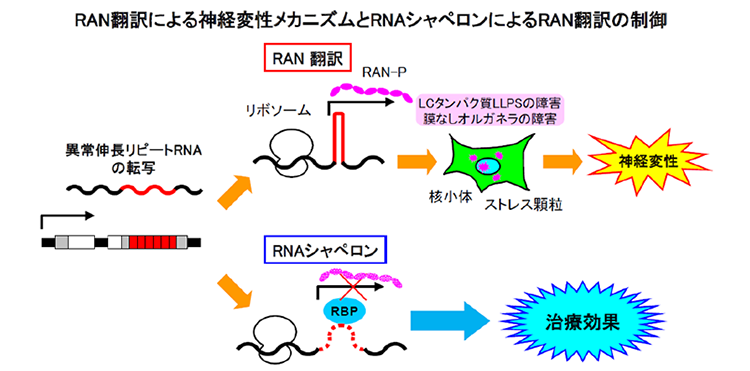
近年、遺伝子非翻訳領域内のリピート配列の異常伸長を原因とする筋萎縮性側索硬化症/前頭側頭型認知症(ALS/FTD)、脊髄小脳失調症(SCA)などノンコーディングリピート病と呼ばれる神経変性疾患において、これらのリピート配列を含む変異RNAは開始コドンAUGを欠くにもかかわらず、これらが鋳型となってリピート関連非AUG依存性(RAN)翻訳という新規の翻訳機構によりリピートペプチド(RAN-P)が産生され、これらが神経毒性を発揮して、神経変性を引き起こすことが明らかにされた。しかしながら、RAN翻訳の分子メカニズム、そしてRAN翻訳産物であるRAN-Pによる神経変性メカニズムは全く未解明である。
森らは、GGGGCCリピート異常伸長変異を原因とする家族性ALS/FTD(C9- ALS/FTD)において、RAN翻訳により産生されたリピートペプチド(RAN-P)が患者脳内に凝集・蓄積していることを明らかにした(Mori et al. Science 2013)。永井らは脊髄小脳失調症31型(SCA31)において、その原因となるUGGAAリピートRNAに結合するTDP-43がリピートRNAの高次構造を解きほぐしてRAN翻訳を抑制し、その結果神経変性を抑制することを明らかにし、RNAシャペロンによるRAN翻訳の制御機構を提唱した(Ishiguro et al. Neuron 2017)。
以上のことから、本計画研究では、RAN翻訳のメカニズムとそれに伴う神経変性メカニズムを解明することを目的として、以下の研究を行う。
1)RAN翻訳レポーター細胞を用いたRAN翻訳分子機構の解明
2)疾患モデル細胞・ショウジョウバエを用いたRAN翻訳の神経変性病態への役割の解明
3)RAN翻訳ペプチドによる神経変性機序の解明
- Shibata T, Nagano K, Ueyama M, Ninomiya K, Hirose T, Nagai Y, Ishikawa K, Kawai G, Nakatani K. Small molecule targeting r(UGGAA)n disrupts RNA foci and alleviates disease phenotype in Drosophila model. Nat. Commun. 12(1), 236 (2021)
プレスリリース: https://resou.osaka-u.ac.jp/ja/research/2021/20210111_1 - Minakawa E.N, Popiel H.A, Tada M, Takahashi T, Yamane H, Saitoh Y, Takahashi Y, Ozawa D, Takeda A, Takeuchi T, Okamoto Y, Yamamoto K, Suzuki M, Fujita H, Ito C, Yagihara H, Saito Y, Watase K, Adachi H, Katsuno M, Mochizuki H, Shiraki K, Sobue G, Toda T, Wada K, Onodera O, *Nagai Y. Arginine is a disease modifier of polyQ disease models that stabilizes polyQ protein conformation. Brain 143(6), 1811-1825 (2020)
プレスリリース: http://www.med.osaka-u.ac.jp/activities/results/2020year/nagai20200527 - Tomioka I, Ishibashi H, Minakawa E.N, Motohashi H.H, Takayama O, Saito Y, Popiel H.A, Puentes S, Owari K, Nakatani T, Nogami N, Yamamoto K, Noguchi S, Yonekawa T, Tanaka Y, Fujita N, Suzuki H, Kikuchi H, Aizawa S, Nagano S, Yamada D, Nishino I, Ichinohe N, Wada K, Kohsaka S, *Nagai Y, Seki K. Transgenic monkey model of the polyglutamine diseases recapitulating progressive neurological symptoms. eNeuro 4(2), ENEURO. 0250-16, 2017 (2017)
- Ishiguro T, Sato N, Ueyama M, Fujikake N, Sellier C, Kanegami A, Tokuda E, Zamiri B, Gall-Duncan T, Mirceta M, Furukawa Y, Yokota T, Wada K, Taylor J.P, Pearson C.E, Charlet-Berguerand N, Mizusawa H, *Nagai Y, *Ishikawa K. Regulatory role of RNA chaperone TDP-43 for RNA misfolding and repeat-associated translation in SCA31. Neuron 94(1), 108-124 (2017)
プレスリリース: http://www.med.osaka-u.ac.jp/activities/results/2017year/article01 - Suzuki M, Fujikake N, Takeuchi T, Kohyama-Koganeya A, Nakajima K, Hirabayashi Y, Wada K, *Nagai Y. Glucocerebrosidase deficiency accelerates an accumulation of proteinase K-resistant α-synuclein and aggravates neurodegeneration in a Drosophila model of Parkinson’s disease. Hum. Mol. Genet. 24(23), 6675-6686 (2015)
プレスリリース: https://www.ncnp.go.jp/press/press_release150916.html - Takeuchi T, Suzuki M, Fujikake N, Popiel H.A, Kikuchi H, Futaki S, Wada K, *Nagai Y. Intercellular chaperone transmission via exosomes contributes to maintenance of protein homeostasis at the multicellular organismal level. Proc. Natl. Acad. Sci. USA 112(19), E2497-2506 (2015)
プレスリリース: https://www.ncnp.go.jp/press/press_release150428.html - *Nagai Y, Inui T, Popiel H.A, Fujikake N, Hasegawa K, Urade Y, Goto Y, Naiki H, Toda T. A toxic monomeric conformer of the polyglutamine protein. Nat. Struct. Mol. Biol. 14 (4), 332-340 (2007)
プレスリリース: http://www.med.osaka-u.ac.jp/activities/results/2007year/article04 - Kawabe Y, *Mori K, Yamashita T, Gotoh S, Ikeda M. The RNA exosome complex degrades expanded hexanucleotide repeat RNA in C9orf72 FTLD/ALS. EMBO J 39(19), e102700 (2020)
プレスリリース: http://www.med.osaka-u.ac.jp/activities/results/2020year/mori-20200827 - *Mori K, Nihei Y, Arzberger T, Zhou Q, Mackenzie I.R, Herrmann A, Hanisch F, German Consortium for Frontotemporal Lobar Degeneration, Bavarian Brain Banking Alliance, Kamp F, Nuscher B, Orozco D, Edbauer D, *Haass C. Reduced hnRNPA3 increases C9orf72 repeat RNA levels and dipeptide-repeat protein deposition. EMBO Rep 17, 1314-1325 (2016)
- Mori K, Weng S.M, Arzberger T, Rentzsch K, Kremmer E, Schmid B, Kretzschmar H.A, Cruts M, van Broeckhoven C, Haass C, *Edbauer D. The C9orf72 GGGGCC repeat is translated into aggregating dipeptide-repeat proteins in FTLD/ALS. Science 339(6125), 1335-1338 (2013)



