

研究分担者松本 俊介
九州大学・農学研究院 助教
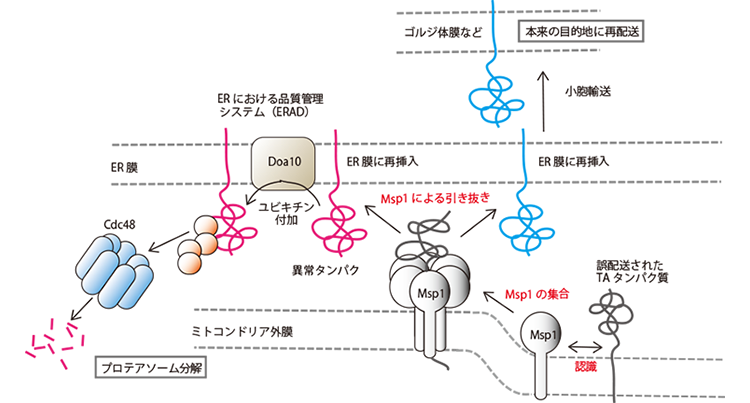
タンパク質は生合成後、あるいは生合成途上に正しく働くべき目的地に配送されねばならない、そのために細胞はタンパク質の正確な細胞内配送を実現するシステムを用意していると考えられてきた。しかし、こうした細胞内のタンパク質局在化の基本原理が崩れつつある。たとえば、タンパク質はただ一つの目的地に配送されるのではなく、二重局在など複数の局在を示すタンパク質が数多く存在する。タンパク質は目的地に到達する前に回り道をすることがある。さらに私たちは、タンパク質の配送には、やり直し(校正)システムが存在することを見出した(Matsumoto et al., Mol. Cell 76, 191-205 (2019))。すなわち、ミトコンドリア外膜のAAA-ATPアーゼのMsp1は、外膜に誤配送されたテイルアンカー(TA)タンパク質をATPのエネルギーを使って引き抜いてER膜に送り込み、ERの強力な品質管理システムに供することで、誤配送タンパク質の分解か配送やり直しかが決まる。ERにも誤配送されたタンパク質を膜から引き抜くタンパク質が存在することが、最近別のグループから報告されるなど、「タンパク質の細胞内配送の校正」は一般的な概念になる可能性がある。本研究では、ミトコンドリアへのタンパク質輸送と品質管理を長年研究してきた利点を活かして、以下の問いに答えるべく研究を推進する。これらの研究を通じて、「タンパク質の配送の校正」という、タンパク質の細胞内局在様式に関わる新たな概念と原理を確立したい。
1)ミトコンドリアに誤配送されたタンパク質の校正システムは、その基質や、働くオルガネラについて、どこまで一般化できるか?
2)サイトゾルや各オルガネラに存在する、タンパク質の配送の校正に関わる因子の全貌は何か?
3) ミトコンドリアへのタンパク質輸送能は様々な要因で変動しうる。この変動に伴う局在の変化、局在が変化したタンパク質の働き、局在が変化したタンパク質の運命、はどのようなものか。
- Takeda H, Tsutsumi A, Nishizawa T, Lindau C, Busto JV, Wenz L-S, Ellenrieder L, Imai K, Straub SP, Mossmann W, Qiu J, Yamamori Y, Tomii K, Suzuki J, Murata T, Ogasawara S, Nureki O, Becker T, Pfanner N, Wiedemann N, Kikkawa M, Endo T. Mitochondrial sorting and assembly machinery operates by β-barrel switching. Nature 590 (7844), 163-169 (2021)
- Watanabe Y, Tamura Y, Kakuta C, Watanabe S, Endo T. Structural basis for inter-organelle phospholipid transport mediated by VAT-1. J Biol Chem. 295, 3257-3268 (2020)
- Araiso Y, Tsutsumi A, Qiu J, Imai K, Shiota T, Song J, Lindau C, Wenz L-S, Sakaue H, Yunoki K, Kawano S, Suzuki J, Wischnewski M, Schütze C, Ariyama H, Ando T, Becker T, Lithgow T, Wiedemann N, Pfanner N, Kikkawa M, Endo T. Structure of the mitochondrial import gate reveals distinct preprotein paths. Nature 575, 395-401 (2019)
- Matsumoto S, Nakatsukasa K, Kakuta C, Tamura Y, Esaki M, Endo T. Msp1 Clears Mistargeted Proteins by Facilitating Their Transfer from Mitochondria to the ER. Mol Cell 76, 191-205 (2019)
- Sato TK, Kawano S, Endo T. Role of the membrane potential in mitochondrial protein unfolding and import. Sci Rep 9(1), 7637 (2019)
- Sakaue H, Shiota T, Ishizaka N, Kawano S, Tamura Y, Tan KS, Imai K, Motono C, Hirokawa T, Taki K, Miyata N, Kuge O, Lithgow T and Endo T. Porin associates with Tom22 to regulate the mitochondrial protein gate assembly. Mol Cell 73, 1044-1055 (2019)
- Ueda E, Tamura Y, Sakaue H, Kawano S, Kakuta C, Matsumoto S and Endo T. Myristoyl group-aided protein import into the mitochondrial intermembrane space. Sci Rep 9(1), 1185 (2019)
- Kawano S, Tamura Y, Kojima R, Bala S, Asai E, Michel A.H, Kornmann B, Riezman I, Riezman H, Sakae Y, Okamoto Y and Endo T. Structure-function insights into direct lipid transfer between membranes by Mmm1-Mdm12 of ERMES. J. Cell Biol 217, 959-974 (2018)
- Arakawa S, Yunoki K, Izawa T, Tamura Y, Nishikawa S and Endo T. Quality control of nonstop membrane proteins at the ER membrane and in the cytosol. Sci Rep 6, Article number, 30795 (2016)
- Shiota T, Imai K, Qiu J, Hewitt V. L, Tan K, Shen H, Sakiyama N, Fukasawa Y, Hayat S, Kamiya M, Elofsson A, Tomii K, Horton P, Wiedemann N, Pfanner N, Lithgow T, Endo T. Molecular architecture of the active mitochondrial protein gate. Science 349 (6255), 1544-1548 (2015)

